¿Qué es un solvente?
Antes de adentrarnos en la versatilidad del agua como solvente, es importante entender qué es exactamente un solvente. En términos sencillos, un solvente es una sustancia capaz de disolver otra sustancia para formar una solución homogénea. Esta capacidad de disolución se debe a la naturaleza polar del solvente, es decir, a su capacidad de atraer y rodear partículas cargadas, como los iones o moléculas polares de las sustancias a disolver.
El agua y su excepcionalidad como solvente
El agua es un solvente excepcional debido a su estructura molecular única y sus propiedades físicas y químicas. A diferencia de otros solventes comunes, como el alcohol o la acetona, el agua presenta una serie de características que la convierten en la opción ideal para una amplia gama de sustancias y procesos.
Tamaño y polaridad de las moléculas de agua
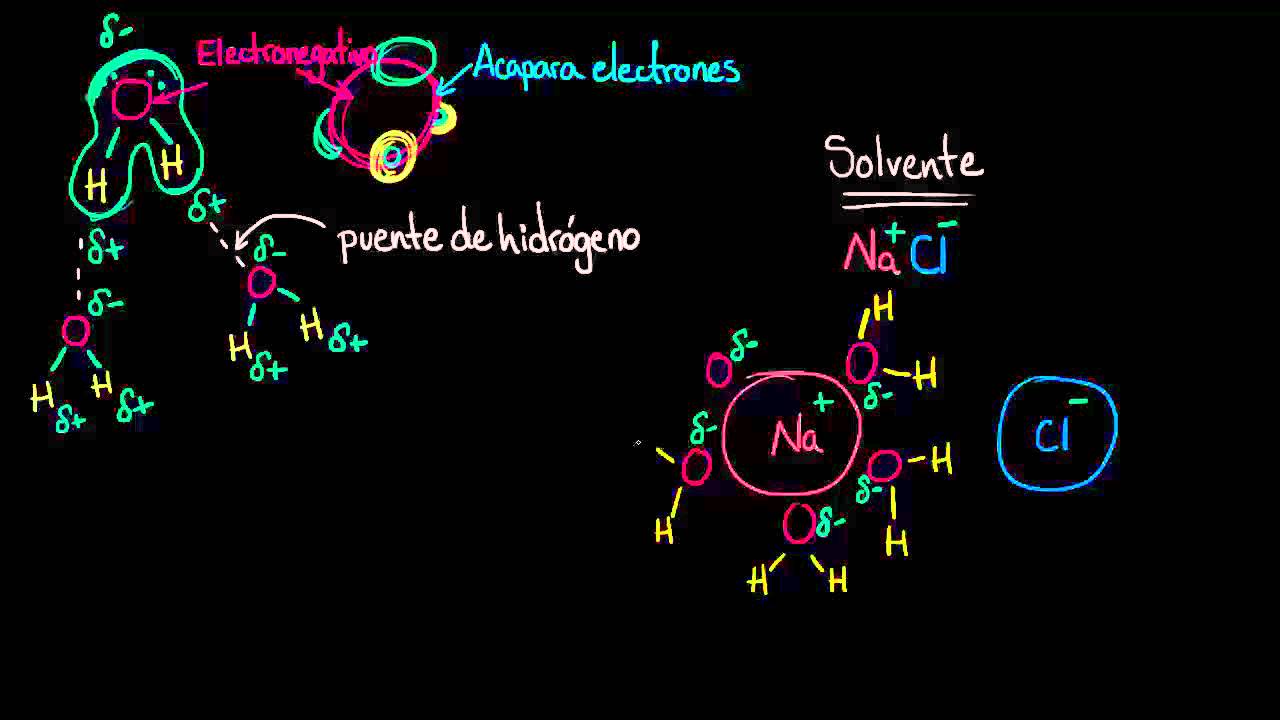
El agua está compuesta por moléculas pequeñas y altamente polares, lo que le permite interactuar con una amplia variedad de compuestos. La molécula de agua está formada por dos átomos de hidrógeno y un átomo de oxígeno, dispuestos en una forma angular. Esta estructura le confiere una carga parcial positiva en los átomos de hidrógeno y una carga parcial negativa en el átomo de oxígeno, lo que la hace altamente polar.
Capacidad para formar puentes de hidrógeno
La polaridad de las moléculas de agua permite que se formen enlaces de hidrógeno entre ellas. Estos enlaces son interacciones débiles que se producen entre el átomo de hidrógeno de una molécula de agua y el átomo de oxígeno de otra molécula de agua. La capacidad del agua para formar puentes de hidrógeno aumenta su capacidad para disolver sustancias polares, ya que puede atraer y rodear eficientemente los iones o moléculas polares de las sustancias a disolver.
Agua como solvente universal
El agua se conoce comúnmente como el “solvente universal” debido a su capacidad para disolver una amplia gama de sustancias. Esta versatilidad se debe a su combinación única de características físicas y químicas mencionadas anteriormente. A continuación, exploraremos algunas de las aplicaciones más comunes del agua como solvente en diferentes ámbitos:
En la naturaleza
El agua es esencial para la vida tal como la conocemos. En la naturaleza, actúa como un solvente vital en numerosos procesos biológicos, facilitando reacciones químicas y transportando nutrientes y desechos a través de los organismos vivos. Por ejemplo, el agua es el principal componente de la sangre, donde actúa como solvente para transportar oxígeno, nutrientes y productos de desecho.
En la química
En el ámbito de la química, el agua se utiliza como solvente en una amplia variedad de reacciones y procesos. Debido a su capacidad para disolver tanto sustancias polares como no polares, el agua es utilizada tanto en disoluciones acuosas como en disolventes orgánicos. Esto es especialmente importante en la síntesis química y en el estudio de reacciones en solución.
En la industria
La versatilidad del agua como solvente también se aprovecha en diversas industrias. Por ejemplo, en la industria alimentaria, el agua se utiliza como solvente para extraer sabores y fragancias de materias primas como las frutas o el café. Además, en la industria farmacéutica, el agua se utiliza como solvente en la producción de medicamentos, ya que puede disolver tanto sustancias polares como no polares.
En resumen, el agua es un solvente excepcional y altamente versátil debido a su estructura molecular única y sus propiedades físicas y químicas. Su capacidad para formar puentes de hidrógeno y su capacidad para disolver tanto sustancias polares como no polares la convierten en el solvente preferido en una amplia gama de aplicaciones, desde procesos biológicos hasta la industria química y alimentaria. Su importancia como solvente universal no puede ser subestimada.
¿Es el agua el único solvente que puede disolver una amplia gama de sustancias?
Aunque el agua es conocida como el “solvente universal”, existen otros solventes que también tienen la capacidad de disolver una amplia gama de sustancias. Sin embargo, debido a sus propiedades únicas, el agua sigue siendo el solvente preferido para many aplicaciones.
¿Por qué el agua es tan buena disolviendo sustancias polares?
El agua es buena disolviendo sustancias polares debido a su polaridad inherente y su capacidad para formar puentes de hidrógeno. Estas interacciones permiten que las moléculas de agua atraigan y rodeen eficientemente los iones o moléculas polares de las sustancias a disolver.
¿Puede el agua disolver sustancias no polares?
Aunque el agua es más eficiente disolviendo sustancias polares, también puede disolver sustancias no polares en cierta medida. Esto se debe a su capacidad para formar enlaces débiles con las moléculas no polares y rodearlas.
¿Existe alguna sustancia que el agua no pueda disolver?
El agua es un solvente muy versátil, pero existen sustancias que son insolubles en ella, como los aceites o grasas. Esto se debe a la naturaleza no polar de estas sustancias, que no pueden ser atraídas y rodeadas eficientemente por las moléculas de agua.
¿Cuál es la importancia de utilizar el agua como solvente en los procesos biológicos?
El agua juega un papel crucial en los procesos biológicos, ya que actúa como solvente para facilitar reacciones químicas y transporte de nutrientes y desechos. Además, el agua también contribuye a mantener un entorno bioquímico óptimo para el funcionamiento de las células y los organismos vivos.